Некоторые патогенетические основы сосудисто-корешкового синдрома вертеброгенной и невертеброгенной этиологии и подходы к лечению и реабилитации (обзор литературы)
Актуальность проблемы вертеброневрологической патологии обусловлена полифакториальным дегенеративным процессом в двигательном сегменте. Международная статистическая классификация болезней и проблем, связанных со здоровьем – МКБ 10, как нормативный документ ВОЗ, предназначенный для обеспечения единства методологических подходов при оценке заболеваемости и причин смерти, но вместе с тем, её применение в качестве образца терминологии для записей клинических диагнозов создает ряд проблем и противоречий с отечественными классификациями. Одной из таких проблем является оценка во взгляде на процессы сосудисто-корешкового синдрома вертеброгенной и невертоброгенной этиологии. Основными задачами оказания помощи пациентам с болевым синдромом при дегенеративных изменениях в позвоночнике являются купирование боли, профилактика обострений, рецидивов болевого синдрома. Ведущим направлением такой помощи является биопсихосоциальной реабилитации с использованием мануальной терапии, массажа, постизометрической релаксации. Дегенеративные изменения позвоночника помимо механической компрессии спинного мозга вызывают сдавление питающих его сосудов, в качестве одного из компонентов комплексной терапии могут быть использованы препараты, препятствующие активации и агрегации тромбоцитов и улучшающие микроциркуляцию. При хронической люмбалгии, люмбоишиалгии необходим индивидуальный подход. Медикаментозная терапия показана лишь при обострении.
Авторы:
Галюков И.А., Быков Е.В.
Уральский государственный университет физической культуры
Челябинск, Россия
Галюкова Н.И.
Челябинск, Россия
Ключевые слова: Вертеброгенная и невертоброгенная патология, Вертеброневрологическая патология, Дорсопатия, МКБ 10, Остеохондроз позвоночника, Полифакториальный дегенеративный процесс, Сосудисто-корешковый синдром
Согласно Международной классификации болезней 10-го пересмотра (МКБ 10) «дорсалгия» – боли в области позвоночника. Считается, что это самая распространенная жалоба у людей среди различных возрастных групп во всем мире, при этом причины бывают весьма разнообразными. Учитывая, эти обстоятельства, мы выполнили анализ существующей информации по данной проблеме.
Дорсопатией (лат. dorsum – «спина», патия – «болезнь») называется группа заболеваний костно-мышечной системы и соединительной ткани, основным проявлением которых является боль не висцеральной этиологии в спине или шее с возможной иррадиацией в туловище, голову или конечности. Вместе с тем, в советской медицине еще в 70-х годах ХХ века сложилось четкое учение, определяемое как «остеохондроз позвоночника» (ОП), которое имело стройную систему знаний и специфических мероприятий лечебно-диагностической и профилактической направленности и имело все признаки сложившейся нозологии [1, 14].
В зарубежной медицине до настоящего времени о пациентах данного профиля нет единого представления, все регистрируемые случаи заболеваний имеют только синдромальное описание, и определяются профессиональной компетенцией специалиста. Как правило, ортопеды и нейрохирурги для обозначения вертеброневрологической патологии используют термин «грыжа диска» или «повреждение фиброзного кольца»; врачи общей практики, хиропрактики и остеопаты - «дорсопатия» или «дорсальгия»; неврологи - «ишиас» и т.д., при этом множество синдромов дегенеративного процесса позвоночника скрывается под определением «миофасциальная боль» [1, 3].
Неоценимый вклад в отечественную и в мировую практику, и в науку в вопросах «вертеброневрологии» внес Я. Ю. Попелянский, изучавший на протяжении многих лет с большой школой ученых и своих последователей поражение нервной системы при дистрофических и дегенеративных процессах в позвоночнике, на стыке неврологии, нейрохирургии и ортопедии, развивая новое направление - ортопедическая неврология [8, 9]. В рамках своего учения он предложил определение остеохондроза позвоночника как полифакториальное дегенеративное заболевание двигательного сегмента, поражающее первично межпозвонковый диск, а вторично – другие отделы позвоночника, опорно-двигательного аппарата и нервную систему» [1, 9].
Параллельно с вышеуказанным учением И. Р. Шмидт конкретизировал основные патоморфологические субстраты остеохондроза позвоночника, такие как внутридисковая дистрофия. Вследствие нарушения фиксационной способности фиброзного кольца происходит формирование нестабильности, а в дальнейшем и грыжи диска, спондилоартроза. Возникающие в результате этого дегенеративно-дистрофические изменения в позвоночно-двигательном сегменте (ПДС), и, как результат этого сужения, межпозвонкового отверстия и спинального канала, приводит к возникновению реактивного асептического лептоменингита или эпидурита (ПДС – анатомический комплекс, состоящий из одного межпозвонкового диска, прилежащих к нему двух смежных позвонков, соединяющего их связочного аппарата и дугоотростчатых суставов) [8].
По мнению В.П. Веселовского при вертеброгенных заболеваниях нервной системы необходимо выделять вертебральный, невральный, нейрососудистый и мышечный синдром [2]. Международная статистическая классификация болезней и проблем, связанных со здоровьем (International Statistical Classification of Diseases and Related Health Problems) или МКБ (ICD), вошла в повседневную практическую деятельность медицинского сообщества как нормативный документ ВОЗ, предназначенный для обеспечения единства методических подходов при оценке заболеваемости и причинах смерти населения. Исходя из самого определения назначения, ее не следует применять и рекомендовать в качестве образца терминологии для записей клинических диагнозов в учетных медицинских документах; ее применение в качестве образца формулирования диагнозов приводит к возникновению ряда проблем при сопоставлении клинических диагнозов с диагнозами, приведенными в МКБ.
В практической деятельности у большинства ученых и врачей сформировалось вполне логичное мнение, что МКБ-10 носит рекомендательный характер и ни в коем случае не заменяет клинические диагнозы, а в ряде случаев ее применение в данном контексте приводит к противоречию и противопоставлению с классификациями ведущих научных и национальных школ. Вследствие этого в научной литературе принято давать двойной диагноз – один согласно МКБ-10, другой – в соответствии с принятыми в РФ классификациями [6, 10, 12, 14, 15].
Относительно самой классификации в разделе дорсопатии существует большое количество противоречий. Остановимся лишь только на тех, которые часто встречаются на практике.
Неврологические проявления остеохондроза позвоночника (НПОП) рекомендуется шифровать в разделе «Дорсопатии» (М40 – М54) класса заболеваний скелетно-мышечной системы и соединительной ткани; при этом в группе «Деформирующие дорсопатии» есть пункт «Остеохондроз позвоночника» (М 42), а в нем содержится код М 42.1 «Остеохондроз позвоночника у взрослых». Однако первым в этой рубрике указан «Юношеский остеохондроз позвоночника» (М42.0), то есть болезнь Кальве, и болезнь Шейермана-Мау, следовательно, термин «остеохондроз» здесь не соответствует общепринятому понятию остеохондроза позвоночника, так как применяется только в случае обозначения остеохондропатий – первичного поражения позвонка, а не диска. Следует отметить, что это сугубо ортопедическая патология вертеброневрологии и не имеет никакого отношения к остеохондрозу [5, 8, 10, 12, 13, 14, 15]. Другим фактом «грубого разрыва» единого нозологического понятия является отнесение «остеохондроза позвоночника» в подраздел «деформирующие дорсопатии» (М42.1), тогда как причину – поражения межпозвонковых дисков (рубрики М50 и М51) относят в рубрику «другие дорсопатии» [15].
Еще большое несоответствие наблюдается в шифровке неврологических проявлений остеохондроза позвоночника «Спондилопатии» (M45 – M49), входящая в него рубрика М47 – «Спондилез» – отражает первичные воспалительные и дистрофические поражения суставов позвоночника, что не соответствует термину «деформирующий спондилез». Рубрика M48 «Другие спондилопатии» включает чисто ортопедическую патологию: спинальный стеноз, болезнь Форестье, «целующиеся» позвонки, травматическую спондилопатию и т.д., данные несоответствия встречаются практически во всех рубриках [7].
В МКБ-10 также отсутствуют понятие о степени выраженности процесса, его обострении и полноте ремиссии, характере течения заболевания и фазности, все это отрицательно влияет на эффективность лечения, преемственность, реабилитацию, проводимых профилактических мероприятий, диспансеризацию, социальную экспертизу и т.д.
Исходя из сказанного, термин «боль в спине» / дорсалгия не подходит для определения «болезнь», ее сложно применить даже к понятию «синдром», так как она имеет всевозможное семиотическое содержание при различных заболеваниях, а охарактеризовать нозологическую форму моносимптомом - это просто нонсенс. Кроме того, заболевания, которые пытаются назвать «дорсопатией», не ограничиваются только болью, а сопровождаются целым рядом других проявлений [4, 5]. В дополнения к сказанному, в МКБ нет рубрики, которая классифицирует сосудисто-корешковые нарушения, связанные как с вертеброгенными, так и невертеброгенными процессами.
Еще в 1982 году И. П. Антонов предложил развернутую клиническую классификацию заболеваний периферической нервной системы (в нее вошли рефлекторные и компрессионные проявления при «вертеброгенных поражениях»), которая является универсальной, и применяется практическими специалистами по настоящее время, несмотря ни на какие «нововведения» [6].
Для рассмотрения предложенной нами темы обязательным условием является понимание определений в рамках терминологии, так как на сегодняшний день сформировалось слишком вольное и непрофессиональное представление о вертеброгенной патологии даже в медицинском сообществе.
В рамках знаний о корешково-сосудисто-спинальной вертеброгении необходимо еще раз обратиться к классификации И. П. Антонова, ее разделу «сосудисто-корешковый синдром», который возникает в результате реактивного воспаления в эпидуральном пространстве, нервном корешке и его оболочках, чаще всего обусловленный протрузией или грыжей межпозвонкового диска, артрозом позвоночных суставов [10].
«Диско-радикулярный конфликт» часто связан не только непосредственно с механическим сдавлением корешков, но и со вторичными реактивными изменениями в области выпячивания (спайками вокруг нервного корешка и грыжей, утолщением и отечностью корешка, разрыхлением, инфильтрацией и уплотнением эпидуральной клетчатки). Под влиянием реактивных изменений резко повышается чувствительность нервного корешка, что в сочетании с оказываемым на него давлением (или с растяжением) вызывает чувство боли. Возникающая при этом радикулопатия – симптом, который по своей сути не является самостоятельным заболеванием, а относится к симптомам заболевания периферической нервной системы, то есть относится к заболеванию вторичного типа, при котором корешок спинного мозга оказывается сдавленным в своеобразном туннеле, образованным различными патологическими процессами. [14].
На сегодняшний день практически все научные работы посвящены изучению патофизиологических основ возникновения болевого синдрома в результате механического компрессионного фактора, при этом нарушению кровоснабжения корешка и спинного мозга уделяется недостаточно внимания, однако это процесс может быть самостоятельной причиной возникновения боли. Применение сосудистой терапии, которая улучшает микроциркуляцию и кровообращение, при болевом синдроме только подтверждает роль сосудистого фактора в генезе аллергических проявлений, а также объясняет положительную динамику при синдромах ирритации и выпадения функции корешка.
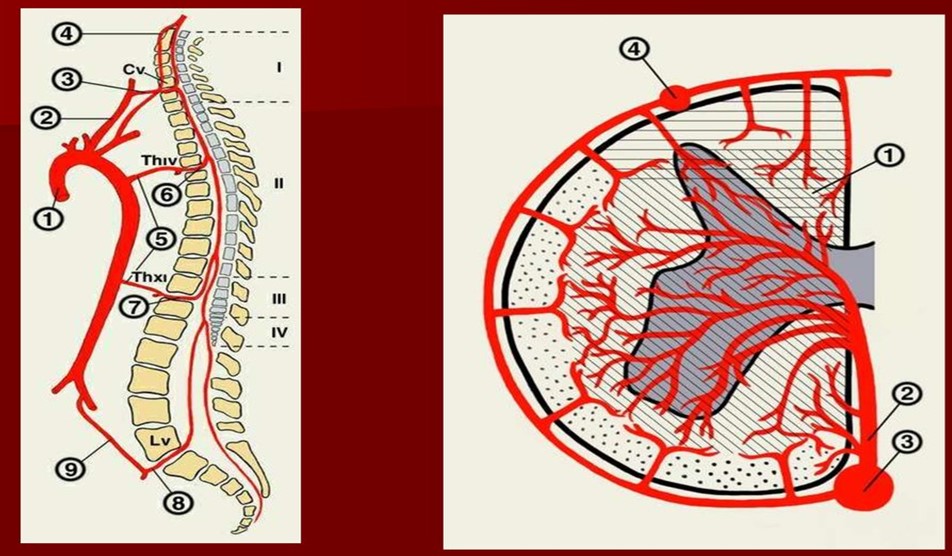
В анатомическом плане кровоснабжение нервных корешков осуществляется радикуломедуллярными артериями. Отходящие от сегментарных артерий, они снабжают 2/3 дистального отдела корешка, а радикуломедуллярные артерии, отходящие от артериальной сети спинного мозга (vasa corona), снабжают оставшиеся 1/3 корешка, также спинномозговые корешки получают питательные вещества из окружающей цереброспинальной жидкости [46].
Спинномозговой узел получает кровоснабжение только от отходящей радикуломедуллярной артерии, которая формирует множество мелких артериол, что в сравнении с кровоснабжением нервного корешка значительно снижено. Также следует отметить, что в области спинномозговых узлов отсутствует развитый гематоневральный барьер, что в целом определяет его чувствительным к ишемии и метаболическим нарушениям [34, 57, 58].
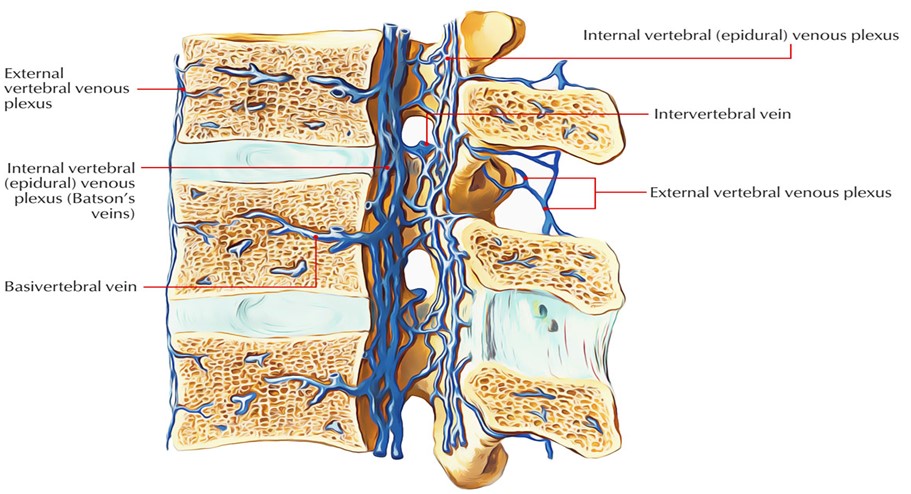
В рамках анатомии венозной системы спинного мозга следует отметить, что она повторяет артериальную систему и имеет два варианта строения: рассыпной и магистральный. По передней и задней поверхностей спинного мозга располагаются одноименные вены — передняя и задняя, она также имеет широкую перимедуллярную сосудистую сеть, откуда кровь оттекает из интрамедуллярных вен, а далее из перимедуллярной сети кровь оттекает по передним и задним корешковым венам, которые соответствуют корешкам. Число корешковых вен составляет от 6 до 35, задние корешковые вены крупнее передних. Учитывая сказанное, вертеброгенные спинальные расстройства венозного кровообращения с компрессией крупной корешковой вены могут развиваться при тех же условиях, что и артериальные радикуломиелопатии и миелопатии. Чаще всего корешковая вена сдавливается при грыже межпозвоночного поясничного диска, но учитывая особенности венозного кровотока, рассмотрим другие факторы этого процесса. Наиболее частой причиной нарушения венозного экстраспинального кровотока на поясничном уровне является застой крови в малом тазу. По патогенезу «застой крови» означает нарушение естественного оттока крови от любого участка. Дисфункция и заболевания органов малого таза не только обуславливают нарушение качества жизни в целом, но и способствуют развитию сосудистой дисциркуляции радикуломедуллярным системам [8, 9].
К органам малого таза, которые участвуют в процессе «застой крови» следует отнести: нижний отдел желудочно-кишечного тракта, включая прямую кишку; мочевой пузырь; у женщин репродуктивные органы: матка, яичники и влагалище; у мужчин: предстательная железа и семенной пузырек. Общепринято считать, что воспалительный процесс в одном из них приводит к возникновению воспаления в остальных.
Основные причины, которые приводят к застою крови в малом тазу:
- гиподинамия, при малоподвижном образе жизни, увеличивается количество жировой ткани, дряблые мышцы пережимают сосуды;
- утягивающее или тесное нижнее белье, сдавливающее сосуды, также ухудшает отток крови;
- варикоз — нарушение эластичности сосудов, их деформация;
- вредные привычки: алкоголь, курение, приводят к спазмированию сосудов, и это, несомненно, отражается на циркуляции крови;
- несбалансированное питание: ткани сосудов постоянно обновляются и, очевидно, для здорового состояния нужно правильное восполнение питательных веществ, которые будут сохранять эластичность стенок;
- проблемы с нервной системой, длительный стресс приводит к спазмированию сосудов, и, соответственно, ухудшается кровоток;
- опущение внутренних органов, то может быть следствием родов, тяжелой беременности или поднятия тяжестей, смещенные органы пережимают сосуды и затрудняют отток;
- у женщин застой может быть спровоцирован особенностями строения матки, например, загибом, побочным эффектом приема оральных контрацептивов, абортами.
Наиболее частыми жалобами являются: боль в пояснице проекционного характера, чувство зябкости в ногах. Боли и в пояснице, и в ноге усиливаются в положении лежа, а при легкой разминке имеют тенденцию к уменьшению.
Клиническая картина венозной радикуломиелопатии отличается рядом особенностей:
- слабость в ногах нарастает исподволь, постепенно, нередко пациент не может четко указать время развития парезов;
- при развитии паретических явлений в нижних конечностях у таких больных болевой синдром длительное время не исчезает;
- обязательным для вертеброгенной венозной радикуломиелоишемии является наличие вертебрального синдрома;
- в пояснично-крестцовом ромбе может наблюдаться венозная сеть – расширенные подкожные вены. Этот симптом является достоверным признаком в диагностике, так как свидетельствует о застойных явлениях в эпидуральной венозной сети, нередко этот признак сочетается с наличием геморроидальных узлов;
- походка у этих больных носит черты сенситивной атаксии («штампующая», смотрит себе под ноги) – расстраивается глубокая и тактильная чувствительность;
- поверхностные же виды чувствительности страдают по сегментарному типу (за счет ишемии задних рогов и роландовой субстанции на протяжении нескольких сегментов);
- пирамидные знаки;
- передние рога и функция тазовых органов страдают незначительно.
Своеобразие жалоб больных и клиники вертеброгенного поражения венозной системы спинного мозга позволяет дифференцировать компрессионную венозную миелопатию и радикуломиелоишемию от несколько схожей картины поражения артериальных сосудов [2, 4, 6, 8].
Еще одной особенностью является то, при ишемии корешка отсутствует корреляция между величиной грыжи межпозвонкового диска и интенсивностью болевого синдрома, а также развитие болевого синдрома при отсутствии сдавления мозговых оболочек и спинномозговых корешков по данным нейровизуализации, при этом в ряде случаев наблюдается снижение кровотока в области спинномозгового узла [13, 14, 25, 58]. Считается, что в этом случае воспалительная реакция носит «иммунный» характер и развивается в ответ на «компрессионное повреждение» [15, 54]. В ответ на раздражение пульпозным ядром глиальные клетки в спинномозговом узле и другие иммунные клетки начинают продуцировать медиаторы воспаления [39, 44].
Основная роль в развитии воспалительной реакции принадлежит цитокинам, в частности интерлейкину (ИЛ)-1b, ИЛ-6 и фактору некроза опухоли-a (ФНО-a). Помимо участия в развитии асептического воспаления цитокины оказывают разрушающее действие на окружающие ткани, а также взаимодействуют с первичными раздражителями, усиливая болевой синдром [18, 59]. В результате воспалительных изменений повышается проницаемость капилляров и развивается отек. Увеличение количества жидкости в периневральном пространстве повышает давление в латеральном отделе позвоночного канала, в результате возникает дополнительная компрессия нервных волокон, периневральной соединительной ткани и сосудов («компартмент-синдром») [19, 51]. При этом выход компонентов плазмы раздражает ноцицептивные окончания, которые содержат вазоактивные нейротрансмиттеры, включающие кальцитонин-ген-родственный пептид и вещество Р [20, 41]. Эти нейропептиды вызывают вазодилатацию и увеличивают проницаемость сосудистой стенки для плазменных альгогенов, способствуя развитию отека и ишемии [21, 35].
Асептическое воспаление как результат процесса локального высвобождения из периферических нервных окончаний вазоактивных нейропептидов является важным для сенситизации нервных окончаний и формирования деафферентационной боли. Помимо механической компрессии спинномозговых корешков, узлов и нервов структурные изменения позвоночника могут вызывать сдавление сосудов микроциркуляторного русла, способствуя развитию ишемии корешков [10, 34, 57]. Уменьшение кровоснабжения корешков приводит к распаду миелиновой оболочки (демиелинизации) нервных волокон, нарушению аксоплазматического транспорта, аксонопатии [22, 36 22].
Повреждение нервных волокон сопровождается макрофагальной инфильтрацией и активацией микроглии в области спинномозгового узла. Результатом этих процессов являются выделение иммунокомпетентными клетками воспалительных медиаторов, возбуждение ноцицептивных окончаний, а также возникновение асептической воспалительной реакции и отека [10, 23, 24 34, 36, 47].
Установлено, что недостаточность артериального кровоснабжения корешка в области межпозвонкового отверстия или позвоночного канала в меньшей степени вызывает метаболические нарушения в нервной ткани, чем компрессия венозного русла. Основная причина микроциркуляторных нарушений при дегенеративных изменениях позвоночника – нарушение оттока венозной крови [22, 27, 28, 36, 56].
По мнению J. Hoyland наиболее тяжелые повреждения нервной ткани связаны с увеличением кровенаполнения в венах [28]. Сдавление вен вызывает увеличение внутрисосудистого давления. Увеличение внутрисосудистого давления на 10–15 мм рт. ст. в значительной степени нарушает отток венозной крови, а увеличение его на 50 мм рт. ст. приводит к замедлению кровотока и венозной гипертензии [24, 25]. При венозной гипертензии линейная и объемная скорость кровотока уменьшается в венах и капиллярах, в них значительно повышается внутрисосудистое давление, что способствует расширению их просвета. Увеличение давления в венах и уменьшение артериовенозного перепада давления приводят сначала к недостаточному току крови из артериол в венулы, а затем и к стазу крови в венах и капиллярах. Повышение внутрисосудистого давления, увеличение проницаемости сосудистых стенок, в свою очередь, способствует выходу компонентов плазмы из сосудистого русла, возникновению отека, воспалительной реакции и очаговой демиелинизации нервной ткани с развитием болевого синдрома [22, 29, 36].
Основное клиническое проявление стеноза позвоночного канала на уровне L4–L5 – нейрогенная перемежающаяся хромота, которая выражается в появлении при ходьбе или длительном стоянии боли, слабости, чувствительных нарушений в одной или обеих ногах, которые уменьшаются в течение нескольких минут, если пациент наклонится кпереди или сядет. В основе заболевания лежит ишемия спинномозговых корешков, которая усиливается при физической нагрузке [21]. Как считает Takahashi у пациентов со стенозом позвоночного канала уровень давления внутри дурального мешка в положении сгибания колеблется от 15 до 18 мм рт. ст., в выпрямленном положении давление увеличивается до 80–100 мм рт. ст. и продолжает повышаться во время ходьбы, в то время как при прекращении физической нагрузки быстро уменьшается [31, 55].
Исходя из сказанного, в области стеноза позвоночного канала увеличение давления внутри дурального мешка приводит к сдавлению пояснично-крестцового сплетения и радикуломедуллярных вен, кроме того, при повышении давления в позвоночном канале происходит нарушение транспорта питательных веществ из цереброспинальной жидкости в спинномозговые корешки [22, 29, 32, 36, 38].
В свою очередь нарушение микроциркуляции сопровождается уменьшением доставки и отдачи кислорода тканям. Развивающаяся гипоксия является причиной метаболического ацидоза, который в конечном итоге приводит к ишемии в спинномозговых корешках. Кроме того, ацидоз активирует кислоточувствительные ионные каналы 3-го типа (ASIC-3), представленные в ноцицепторах спинномозговых узлов, с чем связано возникновение потенциала действия в нейронах болевой чувствительности [33, 34, 53, 57].
В области повреждения спинномозговых узлов и нервных волокон появляются участки патологической импульсации – спонтанной эктопической активности. [9, 23]. Увеличение количества потенциалзависимых натриевых каналов на мембране нервных волокон приводит к чрезмерному поступлению ионов Na + внутрь аксона, вследствие чего и возникает эктопический разряд. Изменение структуры и количества натриевых каналов на мембране нервных волокон регистрируется в участках повреждения миелина, а также в нервных клетках спинномозговых узлов, связанных с поврежденными аксонами. Эктопические разряды, могут возбуждать соседние волокна, вызывая перекрестное (эфаптическое) возбуждение и усиливая афферентный ноцицептивный поток. Клинически это проявляется простреливающей или постоянной болью, парестезиями в области соответствующего дерматома [27, 36].
Высвобождаемые из симпатических волокон катехоламины, с одной стороны, усиливают ноцицептивные импульсы и болевые реакции, а с другой – вызывают вазоспазм, усугубляя ишемические нарушения [10, 34, 39, 40]. Хроническое нарушение микроциркуляции так же, как и длительное асептическое воспаление в области позвоночного канала, приводит к инфильтрации и разрастанию соединительной ткани [33, 37, 40]. В результате нарушается подвижность корешков [22 41], что приводит к их перерастяжению, деформации мембраны нервных волокон и активации механочувствительных каналов ноцицептивных афферентов, которые потенцируют передачу болевых сигналов [9, 29, 42].
Более редкой и тяжелой по сравнению с радикулоишемией является миелопатия, как правило обусловленная дегенеративными изменениями позвоночника [42, 43, 46, 49]. Непосредственной причиной образования очага миелопатии является сдавление спинного мозга грыжей диска или задними остеофитами тел позвонков, врожденным стенозом позвоночного канала, гипертрофия желтой связки, нестабильностью позвоночного сегмента, которые определяют сдавление спинальных сосудов, [37, 42, 46]. Патогенез миелопатии не исчерпывается только механической компрессией спинного мозга. Не меньшее значение имеет сдавление и/или рефлекторные изменения питающих его сосудов, обуславливающих хроническую ишемию спинного мозга [30, 44, 45]. Нейровизуализация и гистологические исследования выявляют фиброз, гиалиноз в интрамедуллярных артериях, а также относительно малый эффект декомпрессивной ламинэктомии позволяют сделать предположение, что симптомы дискогенной миелопатии обусловлены патологией артерий спинного мозга.
Миелопатия может также развиться остро в результате гиперэкстензионной травмы - падение лицом вниз. В случае если у больного при этом имеется врожденный или обусловленный остеохондрозом стеноз позвоночного канала, может произойти преходящее ущемление спинного мозга.
Значение венозной патологии в развитии миелопатии на настоящий момент изучено недостаточно. Вместе с тем деструктивные изменения в спинном мозге, связанные с нарушением венозного кровообращения, встречаются при врожденной патологии венозных сплетений, артериовенозных мальформациях, артериовенозных фистулах, при сопутствующем тромбозе вен нижних конечностей и нижней полой вены, а также в случаях паранеопластического процесса [46, 47, 50].
Таким образом, при развитии миелопатии нельзя отрицать роль нарушения венозного кровообращения, однако основным фактором является ишемия спинного мозга [16, 18, 48–50].
В большинстве случаев дискогенная миелопатия чаще развивается у мужчин в возрасте от 40 до 60 лет. Характерным течением заболевания является медленное нарастание симптомов на протяжении многих месяцев или лет. В типичных варианте дискогенная миелопатия проявляется симптомами компрессии двигательных структур спинного мозга, выраженность парезов обычно незначительная, но встречаются случаи тяжелых тетрапарезов или парапарезов.
Миелопатия на шейном уровне проявляется комбинированным спастико-атрофическим парезом рук, сочетающимся со спастическим парезом ног. По характеру проявления симптомокомплекс напоминает боковой амиотрофический склероз. Реже отмечается периферический парез рук с нижним спастическим парапарезом либо изолированный спастический тетра или парапарез в этом случае атрофия мышц рук сопровождается фасцикуляциями.
Постоянный признак шейной миелопатии проявляется пирамидной симптоматикой, которая выражается в повышении сухожильных и патологических рефлексах. Нарушение тазовых функций (императивные позывы на мочеиспускание) встречается редко. Нарушение поверхностной чувствительности, расстройства глубокой чувствительности, как правило, незначительны и непостоянны. Более частым симптомом нарушения чувствительности являются парестезии в кистях [45, 48].
Частота болевого синдрома встречается до половины случаев. Механизм формирования боли при ишемии спинного мозга обусловлен патологическими изменениями заднего рога, где локализуются вторые нейроны поверхностной чувствительности. Нейропатическая боль при ишемии спинного мозга определяется повышением чувствительности и избыточной активностью нейронов (WRD), залегающих в V пластине заднего рога [26, 43 51, 52, 53]. Хроническая компрессия спинного мозга вызывает активацию клеток микроглии что в сочетании с нарушением гематоэнцефалического барьера приводит к миграции нейтрофилов и макрофагов в область ишемии [20, 29, 57, 58, 59]. Эти процессы обусловливают гиперактивность клеток заднего рога и развитие болевого синдрома с последующей центральной сенситизацией [19, 54]. Гибель олигодендроцитов спинного мозга в результате недостаточного кровоснабжения вызывает демиелинизацию нервных волокон. Признаком вовлечения в патологический процесс задних столбов спинного мозга служит симптом Лермитта: ощущение прохождения электрического тока вдоль позвоночника с иррадиацией в руки и ноги, возникающее вслед за резким наклоном головы. При обратном симптоме Лермитта неприятные ощущения возникают при запрокидывании головы. Хотя данный феномен более характерен для рассеянного склероза, в научной литературе описаны случаи выявления симптома Лермитта и его «обратного эквивалента» при различных состояниях, включая шейную, грудную миелопатию на фоне дегенеративных изменений позвоночника [17, 31, 32, 62–64].
Заключение.
Боль в спине, как общепринято определять – «дорсалгия» (дословно задняя боль) не соответствует определению «болезнь», ее очень сложно соотнести и с понятием «синдром», так как она имеет всевозможное семиотическое содержание при различных заболеваниях, а также и охарактеризовать как нозологическую форму. Кроме того, заболевания, которое пытаются наименовать как «дорсопатия» не ограничивается только болью, а сопровождается целым рядом других проявлений, так нарушение кровоснабжения спинного мозга вследствие дегенеративных изменений позвоночника может быть самостоятельной причиной развития ноцицептивной боли.
МКБ-10 – Международная классификация болезней 10-го пересмотра принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти. По своей сути данный классификатор не может быть признан классификацией заболеваний, так как в целом он в полной мере не отражает клинические аспекты, этиологию, патогенез, стадии и т.д., а в ряде случаев имеет существенные противоречия с клиническими национальными классификациями болезней. В рамках определения проблем вертеброгенного характера необходимо пользоваться отечественной классификацией, предложенной И.П. Антоновым.
Основными задачами оказания помощи пациентам с болевым синдромом при дегенеративных изменениях в позвоночнике являются купирование боли, профилактика обострений, рецидивов болевого синдрома. Ведущим направлением такой помощи является биопсихосоциальной реабилитации с использованием мануальной терапии, массажа, постизометрической релаксации. Дегенеративные изменения позвоночника помимо механической компрессии спинного мозга вызывают сдавление питающих его сосудов, в качестве одного из компонентов комплексной терапии могут быть использованы препараты, препятствующие активации и агрегации тромбоцитов и улучшающие микроциркуляцию. При хронической люмбалгии, люмбоишиалгии необходим индивидуальный подход. Медикаментозная терапия показана лишь при обострении.
Список литературы:
- Алтунбаев, Р. А. «Остеохондроз» или «радикулит» (опыт подхода к терминологической дилемме) / Р. А. Алтунбаев // Неврологический вестник. – 1996. – Т. XXVIII, вып. 1-2. – С. 44 – 50.
- Веселовский, В. П. Практическая вертеброневрология и мануальная терапия / В. П. Веселовский – Рига, 1991. – 343 с.
- Википедия – свободная энциклопедия. [Электронный ресурс]. – Режим доступа: http://ru.wikipedia.org/wiki/Ишиас
- Гуща, А. О. Болевой синдром при дегенеративно-дистрофических изменениях позвоночника. / А. О. Гуща, Е. В. Герасимова, Е. Н. Полторако. Анналы клин. и экспериментальной неврологии. 2018; 12 (4) – С. 67–75.
- Кипервас, И. П. Идеи проф. Я.Ю. Попелянского в Америке (термин «остеохондроз позвоночника» введен в словарь американских радиологов). / И. П. Кипервас. [Электронный ресурс]. – Режим доступа: http://www.russianseattle.com/spinalneurology/2_popelyanskiy_in_usa_rus.shtml
- Классификация болезней нервной системы. / Под ред. Н. Г. Дубровской. – М. : Триада-Х, 2002. – 256 с.
- Коновалов, А. Н. Клинические рекомендации по диагностике и лечению дегенеративного стеноза позвоночного канала на пояснично-крестцовом уровне. / А. Н. Коновалов, А. А. Гринь, О. Н. Древаль и др. Обсуждены и утверждены на пленуме Правления Ассоциации нейрохирургов России, Казань. 2015. М : 2015.
- Луцик, А. А. Спондилоартроз. / А. А. Луцик, И. Р. Шмидт., Е. Б. Колотов. – Новосибирск : Издатель, 2003. – 290 с.
- Попелянский, А. Я. Взгляд невропатолога и мануального терапевта (комментарии, раздумья, разъяснения). / А. Я. Попелянский. [Электронный ресурс]. – Режим доступа: http://www.russianseattle.com/spinalneurology/index.shtml
- Попелянский, Я. Ю. Ортопедическая неврология (вертеброневрология): руководство для врачей. /Я. Ю. Попелянский. – М. : МЕДпресс-информ, 2003. – 672 с.
- Форум о позвоночнике. [Электронный ресурс]. – Режим доступа: http://www.medhouse.ru/forum4/thread8484.html#post52431
- Хить, М. А., Гуща А.О., Щекутьев Г.А., Никитин С.С. Шейная спондилогенная миелопатия: диагностика, лечение, прогноз. / М. А Хить, А. О. Гуща, Г. А. Щекутьев, С. С. Никитин. Вопр. нейрохирургии им. Н. Н. Бурденко 2012; 76 (3): С. 75 – 80.
- Челноков, В. А. Особенности трактовки современной теории патогенеза остеохондроза позвоночника в спортивной медицине./ В. А Челноков // Теория и практика физической культуры, 2004 № 1 [Электронный ресурс]. – Режим доступа: http://lib.sportedu.ru/press/tpfk/2004n1/p12-15.htm
- Шмидт, И. Р. Диагноз неврологических проявлений остеохондроза позвоночника и его адаптация к МКБ-10: Методические рекомендации. / И. Р. Шмидт, B. C. Саяпин, В. Ф. Малевик и др., Новокузнецк, 2004, 40 с.
- Шмидт, И. Р. Решенные и нерешенные проблемы вертеброневрологии на современном этапе развития науки. / И. Р. Шмидт // Медицина Кузбасса, 2004. – № 2. – С. 13 – 17.
- Эрдес, Ш. Ф. Остеохондроз – особенности отечественной интерпаретации болезни / Ш. Ф. Эрдес, О. М. Фломеева. // Научно-практическая ревматология. – 2010. – № 4. – С.87 – 93.
- Al-Mefty, O. Experimental chronic compressive cervical myelopathy. / O. Al-Mefty, H. L. Harkey, I. Marawi et al. J Neurosurg 1993; 79 (4) : 550–61.
- Baldwin, R. N.. Lhermitte's "sign" due to thoracic cord compression. / R. N.Baldwin, D. Chadwick. J Neurol Neurosurg Psychiatry 1986; 49 (7) : 840 – 1.
- Carvalho, D Z. Venous Congestive Myelopathy due to Chronic Inferior Vena Cava Thrombosis Treated with Endovascular Stenting: Case Report and Review of the Literature. / D. Z. Carvalho, J. D. Hughes, G. B. Liebo et al. J Vasc Interv Neurol 2015; 8 (1) : 49 – 53.
- D'Mello R. Spinal cord mechanisms of pain. / R. D'Mello, A. H. Dickenson. Br J Anaesth 2008; 101 (1) : 8 – 16.
- Donnelly, D. J. Inflammation and its role in neuroprotection, axonal regeneration and functional recovery after spinal cord injury. / D. J. Donnelly, P. G. Popovich. Exp Neurol 2008; 209 (2) : 378–88.
- Dubový, P. Wallerian degeneration and peripheral nerve conditions for both axonal regeneration and neuropathic pain induction. / P. Dubový. Ann Anat 2011; 193 (4) : 267 – 75.
- Falconer, M. A. Observations on the cause and mechanism of symptomproduction in sciatica and low-back pain. / M. A. Falconer, M. McGeorge, A. C. Begg. J Neurol Neurosurg Psychiatry 1948; 11 : 13 – 26.
- Gilchrist, R. V. Anatomy of the intervertebral foramen. / R. V. Gilchrist, C. W. Slipman, S. M. Bhagia. Pain Physician 2002; 5 (4) : 372 – 8.
- Gilchris,t R. V. Vascular Supply to the Lumbar Spine: An Intimate Look at the Lumbosacral Nerve Roots. / R. V. Gilchrist, C. W Slipman, Z. Isaac et al. Pain Physician 2002; 5 (3) : 288 – 93.
- Guo, W. Correlation studies between MRI and the symptom scores of patients with LDH before and after manipulative therapy. / W. Guo, P. Zhao, W. Zhou et al. Zhongguo Gu Shang 2010; 23 (1) : 17 – 9.
- Hao, J.H. Hypersensitivity of dorsal horn wide dynamic range neurons to cutaneous mechanical stimuli after transient spinal cord ischemia in the rat. / J. H. Hao, X. J. Xu, Y. X. Yu et al. Neurosci Lett 1991; 8: 128 (1) : 105 – 8.
- Harvey, V.L. Mechanisms of pain in nonmalignant disease. / V. L. Harvey, A. H. Dickenson. Curr Opin Support Palliat Care 2008; 2 (2) : 133 – 9.
- Hoyland, J. A. Intervertebral foramen venous obstruction. A cause of periradicular fibrosis? / J. A. Hoyland, A. J. Freemont, M. I. Jayson. Spine (Phila Pa 1976) 1989; 14 (6) : 558 – 68.
- Ifergan, I. The blood-brain barrier induces differentiation of migrating monocytes into Th17-polarizing dendritic cells. / I. Ifergan, H. Kébir, M. Bernard et al. Brain 2008; 131 (Part 3) : 785 – 99.
- Karadimas, S. K. A novel experimental model of cervical spondylotic myelopathy (CSM) to facilitate translational research. / S. K. Karadimas, E. S. Moon, W. R. Yu. Neurobiol Dis 2013; 54 : 43 – 58.
- Kempster, P. A. The Lhermitte phenomenon: variant forms and their significance. / P. A. Kempster, R. D. Rollinson. J Clin Neurosci 2008; 15 (4) : 379 – 81.
- Khare, S. Lhermitte's Sign: The Current Status. / S. Khare, D. Seth. Ann Indian Acad Neurol 2015; 18 (2) : 154 – 6.
- Kobayashi, S. Microvascular system of the lumbar dorsal root ganglia in rats. Part I: a 3D analysis with scanning electron microscopy of vascular corrosion casts. / S. Kobayashi, E. S. Mwaka, H. Baba et al. J Neurosurg Spine 2010; 12 (2) : 197 – 202.
- Kobayashi, S. Microvascular system of the lumbar dorsal root ganglia in rats. Part II: neurogenic control of intraganglionic blood flow. / S. Kobayashi, E. S. Mwaka, H. Baba J Neurosurg Spine 2010; 12 (2) : 203 – 9.
- Kobayashi, S. Vasomotion of Intraradicular Microvessels in Rat. / S. Kobayashi, E. S. Mwaka, A. Meir et al. Spine 2009; 34 (10) : 990 – 7.
- Kobayashi, S. Effects of Arterial Ischemia and Venous Congestion on the Lumbar Nerve Root in Dogs. / S. Kobayashi, K. Takeno, T. Miyazaki et al. J Orthop Res 2008; 26 (11) : 1533 – 40.
- Kobayashi, S. Pathomechanisms of sciatica in lumbar disc hernia-tion: effect of periradicular adhesive tissue on electrophysiological values by an intraoperativestraight leg raising test. / S. Kobayashi, K. Takeno, T. Yayama et al. Spine (Phila Pa 1976) 2010; 15; 35 (22) : 2004 – 14.
- Kobayashi, S. Pathophysiology, diagnosis and treatment of intermittent claudication in patients with lumbar canal stenosis. / S. Kobayashi.World J Orthop 2014; 18; 5 (2) : 134 – 45.
- Krames, E. S. The role of the dorsal root ganglion in the development of neuropathic pain. / E. S. Krames. Pain Med 2014; 15 (10) : 1669 – 85.
- Kummer, W. Catecholamines and catecholamine-synthesizing enzymes in guinea-pig sensory ganglia. / W. Kummer, I. L. Gibbins, P. Stefan, V. Kapoor. Cell Tissue Res 1990; 261 (3) : 595 – 606.
- Lawson, S. N. Morphological and biochemical cell types of sensoryneurons. / S. N. Lawson,. In: Scott AS, ed. Sensory Neurons, Diversity, Development and Plasticity. / NY : Oxford University Press, 1992; p. 27 – 59.
- Lin, J. H. umbar radiculopathy and its neurobiological basis. / J. H. Lin, Y. H. Chiang, C. C. Chen. World J Anesthesiol 2014; 3 (2) :162 – 73.
- McKinley, W. O. Comparison of medical complications following nontraumatic and traumatic spinal cord injury. / W. O. McKinley, M. A. Tewksbury, C. J. Godbout. J Spinal Cord Med 2002; 25 : 88 – 93.
- Molinos, M. Inflammation in intervertebral disc degeneration and regeneration. / M. Molinos, C. R. Almeida, J. Caldeira. J.R Soc Interface 2015; 6; 12 (104) : 20141191.
- New, P. W. Nontraumatic spinal cord injury: demographic characteristics and complications. / P. W. New, H. B. Rawicki, M. J. Bailey. Arch Phys Med Rehab 2002; 83 : 996 – 1001.
- Nouri, A. Degenerative Cervical Myelopathy: Epidemiology, Genetics, and Pathogenesis. / A. Nouri, L. Tetreault, A. Singh et al. Spine (Phila Pa 1976) 2015; 15; 40 (12) : E675 – 93.
- Oyinkan, M. B. Myelopathy / M. B. Oyinkan, P. M.Capone/. – Handb Clin Neurol 2016; 136: Е1015–26.
- Otoshi, K. The reactions of glial cells and endoneurial macrophages in the dorsal root ganglion and their contribution to pain-related behavior after application of nucleus pulposus onto the nerve root in rats. / K. Otoshi, S. Kikuchi, S. Konno, M. Sekiguchi. Spine (Phila Pa 1976) 2010; 35 : 264 – 71.
- Oyinkan, M. B. Myelopathy. / M. B. Oyinkan, P. M. Capone. Handb Clin Neurol 2016; 136 : 1015 – 26.
- Rodriguez, F. J. Venous congestive myelopathy: a mimic of neoplasia. / F. J. Rodriguez, B. A. Crum, W. E. Krauss et al. Mod Pathol 2005; 18 (5) : 710 – 8.
- Rydevik, B. L. Pressure increase in the dorsal root ganglion following mechanical compression. Closed compartment syndrome in nerve roots. / B. L. Rydevik, R. R. Myers, H. C. Powell. Spine (Phila Pa 1976) 1989; 14 (6) : 574 – 6.
- Sapunar, D. Dorsal root ganglion – a potential new therapeutic target for neuropathic pain. / D. Sapunar, S. Kostic, A. Banozic, L. Puljak. J Pain Res 2012; 5 : 31 – 8
- Sluka, K. A. Acid-sensing ion channels: A new target for pain and CNS diseases. / K. A. Sluka, O. C. Winter, J. A. Wemmie. Curr Opin Drug Discov Devel 2009; 12 (5) : 693 – 704.
- Sun, Z. Immune cascades in human intervertebral disc: the pros and cons. / Z. Sun, M. Zhang, X. H. Zhao. Int J Clin Exp Pathol 2013; 6 (6) : 1009 – 14.
- Takahashi, K. Changes in epidural pressure during walking in patients with lumbar spinal stenosis. / K. Takahashi, K. Kagechika, T. Takino et al. Spine (Phila Pa 1976) 1995; 15; 20 (24) : 2746 – 2749.
- Watanabe, R. Vascular and neural pathology of lumbosacral spinal nerve roots in spinal stenosis. / R. Watanabe, W. W. Parke. J Neurosurg 1986; 64 : 64 – 70.
- Wu, W. L. Targeting ASIC3 for pain, anxiety, and insulin resistance. / W. L. Wu, C. F. Cheng, W. H. Sun et al. Phamacol Ther 2012; 134 (2) : 127 – 138.
- Yabuki, S. Acute effects of nucleus pulposus on blood flow and endoneurial fluid pressure in rat dorsal root ganglia. / S. Yabuki, S. Kikuchi, K. Olmarker, R. R. Myers. Spine (Phila Pa 1976) 1998; 23 : 2517 – 23.
- Zhang, J.M. Cytokines, Inflammation and Pain. / J. M. Zhang, A. N. Jianxiong. Int Anesthesiol Clin 2007; 45 (2) : 27–37.
Информация об авторах:
Быков Евгений Витальевич – доктор медицинских наук, профессор, заведующий кафедрой спортивной медицины и физической реабилитации, проректор по научно-исследовательской работе, Уральский государственный университет физической культуры. Челябинск, Россия.
454091, г. Челябинск, ул. Орджоникидзе, 1.
bykovev@uralgufk.ru.
Галюков Игорь Анатольевич – доктор медицинских наук, доцент, профессор кафедры спортивной медицины и физической реабилитации, Уральский государственный университет физической культуры. Челябинск, Россия.
454091, г. Челябинск, ул. Орджоникидзе, 1.
Галюкова Наталья Ивановна – доктор медицинских наук, врач-фтизиатр ГБУЗ «ЧОДТБ». Челябинск, Россия.
Опубликовано на сайте журнала 11 марта 2024. Прямая ссылка на статью: https://nsjuralgufk.ru/articles/80